名家风采11月7日手术直播四川大
-这里是全国顶级专家及团队的高精尖学术分享舞台,精彩不容错过!
向上滑动阅览
医院肝脏外科/肝脏移植中心依托国家教育部重点学科—医院普外科和卫生部肝胆胰研究室,是在医院肝移植协作组的基础上,结合各学科的人才、技术优势而建立的跨学科、跨专业的集医疗、教学、科研于一体的医疗和研究机构。中心包括72张床位的移植病区、移植免疫研究室及微循环和组织配型研究室。是国家重点学科、卫健委临床重点专科、教育部重点学科、国家“工程”建设学科、英国爱丁堡皇家外科学院和香港外科医学院认证的普外科专科医师培训基地、西部肝癌诊治中心。中心专业技术队伍阵容强大,共有教授、博导8人(均为欧、美、日本等学成回国者),副教授、副主任医师16人,博士后、博士生30余人。
科研力量雄厚,近年仅肝脏外科、肝移植就承担了国家自然科学基金、国家教委、国家科技部“项目”、“十、一五支撑计划项目”、卫生部、省卫生厅课题、省重点课题30余项。获国家级、省部级科研成果奖10余项,在国内外医学杂志发表论文余篇,其中在国外专业权威期刊和发表论文余篇。
以患者为中心,努力实践“为病人服务、使病人以最少的花费得到最合理的治疗”。长期以来不断创新手术技术,勇攀医学高峰。尤其在微创和移植两个前沿领域中,均达到国际领先水平。
肝癌规范化诊治:常规开展各类肝切除术、肝移植术、肝癌局部治疗、肝动脉化疗栓塞术、分子靶向治疗等。近年来还新开展了联合肝脏离断与门静脉结扎的二步肝切除术、PVE诱导下的二步肝切除术、LVD诱导下的二步肝切除术等。
肝脏移植:最先在国内开展肝移植的单位之一,最早在国内开展并完成最多成人间活体肝移植,完成了国内第一例双供肝肝移植、国际第一例尸体部分肝加活体部分肝合成肝移植、国际第一例布加综合征活体肝移植。肝移植花费国内最低,疗效优异,处于国际先进、全国领先水平。现常规开展心脏死亡器官捐献(DCD)肝移植、成人及小儿活体肝移植、劈离式肝移植等。
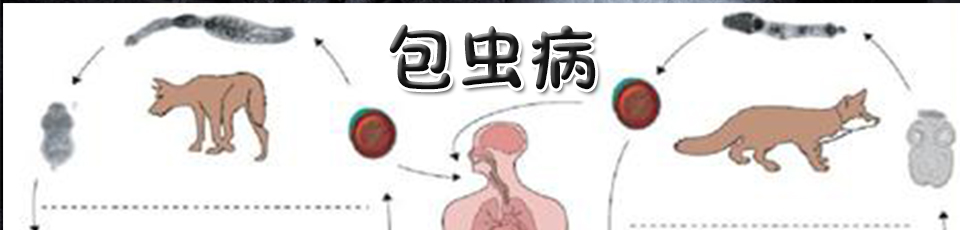
肝包虫病诊治:国内少数可以开展离体肝切除联合自体肝脏移植治疗肝包虫病的单位之一,完成了国内最多、难度最大的离体肝切除联合自体肝脏移植术,可常规开展内囊摘除术、肝切除术、离体肝切除联合自体肝脏移植术。
微创供肝切取与微创肝切除:国内较早开展微创肝切除的中心之一,完成了国内第一例全腹腔镜活体右半供肝切取术,常规开展腹腔镜肝切除、腹腔镜供肝切取、达芬奇机器人辅助肝切除术。
向上滑动阅览
1
医院肝脏外科曾勇和吴泓教授团队:长链非编码RNASNHG10通过正反馈环路调控其同系衍生物SCARNA13促进肝癌发生和转移
肝细胞肝癌(简称肝癌)是一种常见的恶性肿瘤。在我国,肝癌在所有癌症中的发病率排名第5位,患者的死亡率高居第2位。虽然临床诊断和治疗方式日新月异,但是肝癌患者的预后仍然没有得到显著性的改善,5年生存率低于30%。造成这种结果的主要原因包括肝癌早期诊断困难、相对较高的术后复发率和转移率。因此,探索更为准确的早期诊断标志物和更为有效的治疗靶点具有重大的临床意义。目前,肝癌发生和转移的机制尚不清楚,被认为是细胞自身特性的改变和外部微环境的影响而导致肝细胞的恶性转化。近年来,肿瘤表观遗传学和高通量测序技术的发展为阐明肿瘤发生发展的分子机制和发现新的分子诊治靶点起到了关键性的作用。
曾勇教授和吴泓教授团队的该项研究鉴定出了在肝癌发生和转移过程的关键分子——长链非编码RNA(lncRNA)SNHG10和其同系衍生物SCARNA13。其研究结果表明,lncRNASNHG10和SCARNA13协同促进了肝癌细胞的恶性表型转化。
该研究通过构建小鼠肝癌肺转移模型并结合高通量测序技术,从表观遗传学的角度筛选出SNHG10和SCARNA13作为肝癌发生发展的重要驱动。结合肝癌患者的临床资料,高表达SNHG10或SCARNA13的患者生存率显著较低。SCARNA13可作为预测肝癌患者总体生存率的独立危险因素。该研究进一步发现,lncRNASNHG10能够通过调控SCARNA13从而促进肝癌细胞的增殖和转移。通过开展一系列的分子生物学实验以及转录组学和蛋白组学分析,该研究证实lncRNASNHG10通过吸附miR--5p和结合RPL4mRNA,进而促进c-Myb的表达水平和功能活性,而c-Myb又可结合并激活SNHG10的启动子,从而形成一个正反馈环路,并不断刺激SCARNA13的表达,进而上调SOX9,最终促进肝癌细胞的增殖、凋亡抵抗和转移。
该研究结果鉴定出了一条在肝癌发生和转移中发挥重要调控作用的复杂信号环路(图1),有助于从分子水平理解肝癌的病理过程和确立新的肝癌分子诊治靶点。
2
医院肝脏外科王文涛教授团队:离体肝切除联合自体肝移植治疗终末期泡型肝包虫病中的技术创新及初步临床实践结果
离体肝切除联合自体肝移植技术(exvivoliverresectionandautotransplantation,ERAT)最早由德国外科医生Pichlmayr于年报道应用于切除一些常规肝切除术所无法触及的复杂肝脏恶性肿瘤[1],如侵犯下腔静脉和腔-肝汇合部的肝细胞癌或肝门胆管癌等。手术主要包括肝脏探查与离体、肝脏低温灌注及体外肝切除、余肝回植及管道重建三大步骤。其主要目的是利用活体肝脏移植和体外劈离肝脏移植技术、体外冷保存和受体自身转流等技术规避复杂肝脏手术操作的出血风险以及因血管阻断而造成的肝脏缺血。早期该工作用于相对容易手术的晚期癌症治疗,但由于手术技术复杂和癌症疾病的病期情况,围术期死亡率和并发症发生率高,即使少数存活的患者也多死于癌症复发,故近年来ERAT已极少用于治疗肝脏恶性肿瘤。另一方面,ERAT牵涉到诸如血流动学稳态维持、复杂管道重建、器官冷保存等多项尖端外科技术,在世界范围内也仅有少数几家中心和少数医生团队有能力开展这样复杂的手术,故进入本世纪以来,ERAT开展不足百例,成为了肝脏外科一项难以攻克的巅峰技术。
泡型肝包虫病是由多房棘球蚴感染肝脏引起的一种致死性寄生虫性传染病,其病灶呈浸润性生长,不断长入周围正常组织,与肝脏恶性肿瘤生长方式类似,故而被称为“虫癌”[2],其中未经治疗的泡型包虫病人10年病死率高达94%。晚期泡型肝包虫病常因体积巨大,可侵犯肝脏血管、胆管等重要结构和周围邻近器官使得在体肝切除因术中凶险的大出血和无法重建严重被侵犯的肝脏重要结构而无法完成(图1)。而异体肝移植技术则存在着肝脏供体等待时间长、医疗费用高昂以及术后免疫抑制治疗带来的高复发率。医院肝脏外科王文涛教授团队研究发现,许多晚期泡型肝包虫病病例虽然肝脏大半已被病灶破坏,但仍保有部分稍有正常结构肝脏组织,如果能充分利用患者剩余的正常肝组织,便可拯救更多没有机会接受肝切除和肝移植的病人。该团队创新性将晚期泡型肝包虫病和低度恶性肿瘤及其他肝脏良性占位性疾病作为ERAT的手术适应症,使ERAT技术焕发出新的活力。
图1 示巨大的晚期泡型肝包虫病病灶
A:术前CT影像;B:技术辅助三维重建模型;C:术中所见
本次活动中
强生能量器械HDi、ACE+7
以及吻合技术PVS将重磅登场
滑动查看成员简历
李靖
医院肝胆外科主任
教授、主任医师、医学博士、博士研究生导师
中华医学会外科学分会胆道外科学组委员
中国医师协会肝癌专业委员会委员
医院学会数字医学临床外科专业委员会常务委员
陈雄
新疆医院肝胆外科主任
主任医师
新疆医学会第六届普通外科专业委员会常务委员
新疆医学会外科学分会手术学组副组长
新疆医学会器官移植学会常委
电脑端观看链接
转载请注明:http://www.sonphie.com/jbjc/11771.html